





《《有机化学·烷烃》清华大学化学PPT课件(共129页)》是由用户上传到老师板报网,本为文库资料,大小为2.31 MB,总共有129页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 129页
- 2.31 MB
- VIP模板
- ppt
- 数字产品不支持退货
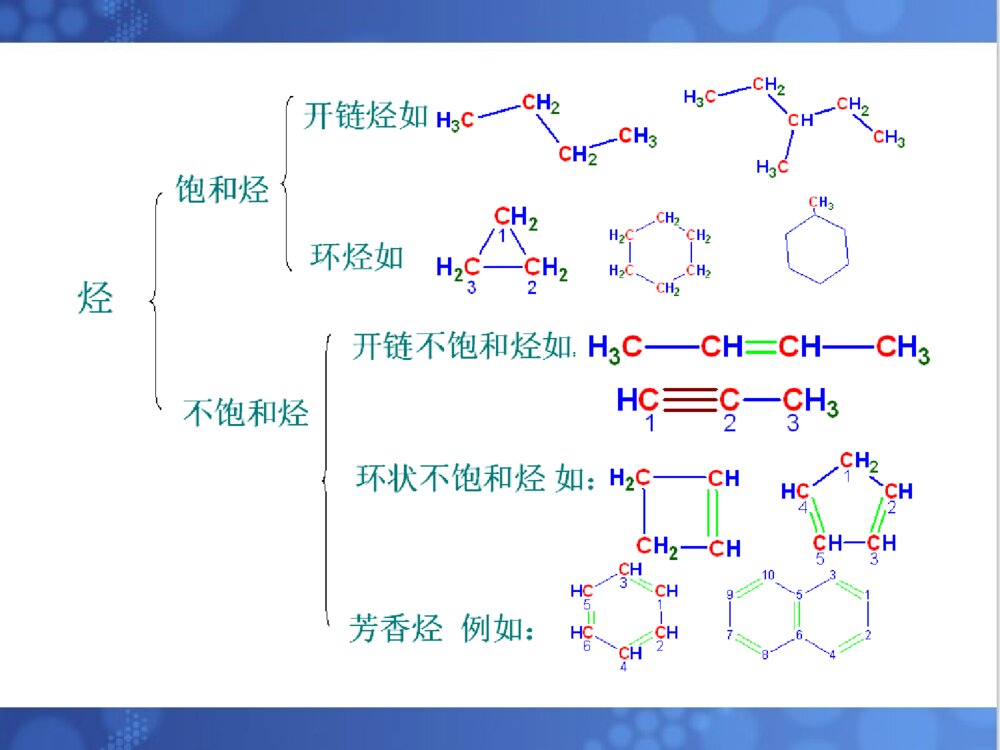
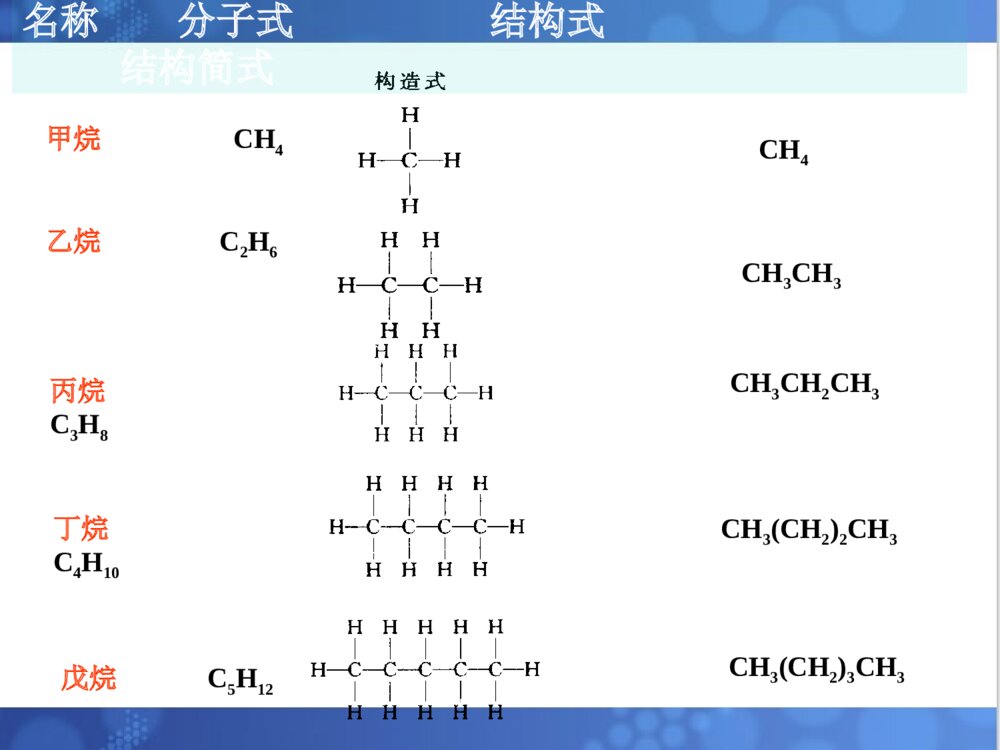
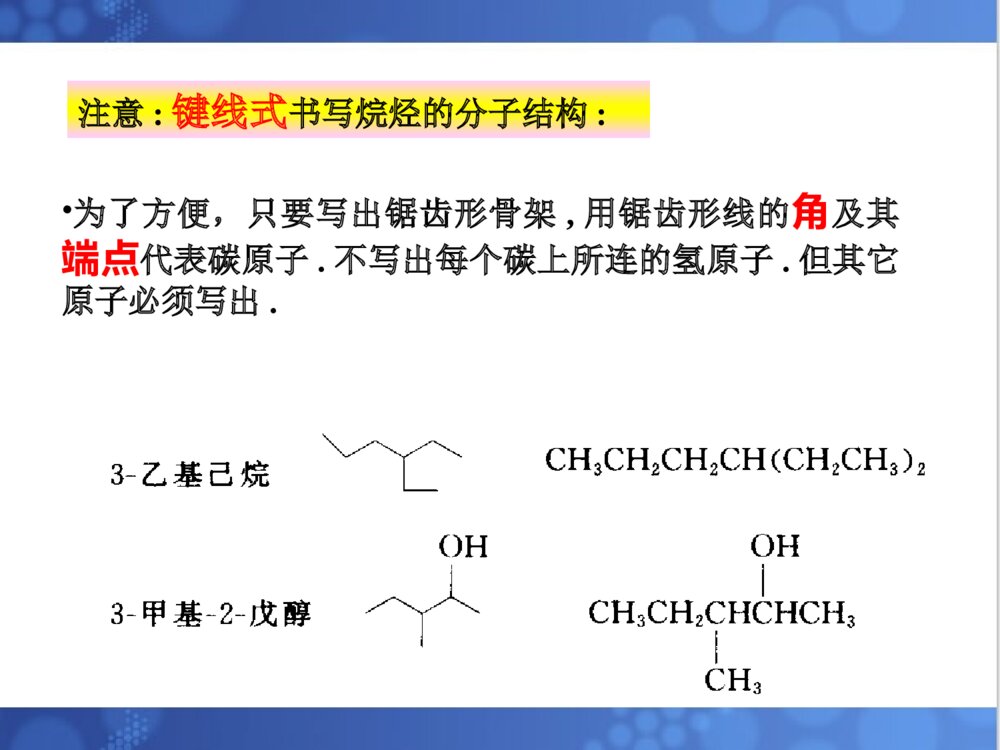
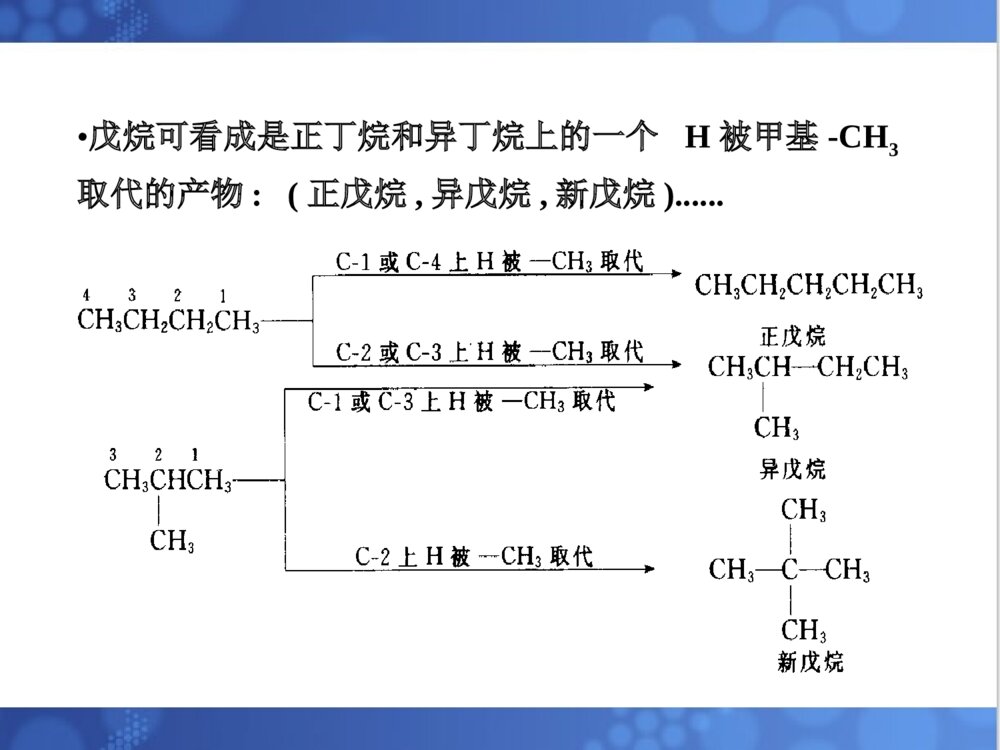
烷烃一烃的定义•分子中只含有C、H两种元素的有机化合物叫碳氢化合物,简称烃.二烃的分类:根据烃分子中碳原子连接方式1)脂肪烃:饱和烃和不饱和烃2)脂环烃:分子中碳原子联结成闭合碳环3)芳香烃:含芳香环的一大类烃化合物,如苯环(1)烷烃—碳原子的四个共价键,除以单键与其他碳原子相互结合成碳链外,其余的价键也都和氢原子相结合,即完全为氢原子所饱和。又叫饱和烃,石蜡是烷烃的混合物例如:甲烷,乙烷,丙烷,丁烷(正丁烷,异丁烷),戊烷(正戊烷,异戊烷,新戊烷)......2.1烷烃的通式,同系列和同分异构丙烷C3H8丁烷C4H10戊烷C5H12CH3CH2CH3CH3(CH2)2CH3CH3(CH2)3CH3CH4CH3CH3甲烷CH4乙烷C2H6名称分子式结构式结构简式•为了方便,只要写出锯齿形骨架,用锯齿形线的角及其端点代表碳原子.不写出每个碳上所连的氢原子.但其它原子必须写出.注意:键线式书写烷烃的分子结构:(2)烷烃的通式——直链烷烃分子中,一个或几个-CH2-基团(亚甲基)连成碳链,碳链的两端再连有两个氢原子,因此直链烷烃的通式可写为:H-(-CH2-)n-H或:CnH2n+2•同分异构体——由于分子式相同,但它们的构造不同(分子中各原子相连的方式和次序不同).又叫构造异构体。•戊烷可看成是正丁烷和异丁烷上的一个H被甲基-CH3取代的产物:(正戊烷,异戊烷,新戊烷)......烷烃分子中,随着碳原子数的增加,烷烃的构造异构体的数目也越多.写出C10H22的同分异构体?烷烃的通式CnH2n+2,直链烃的通式可写为:H-(-CH2-)n-H同系物—在组成上相差一个或多个CH2,且结构和性质(官能团种类和个数相同)相似的一系列化合物称为同系列.同系列中的各化合物互称同系物.系差—同系列相邻的两个分子式的差值CH2称为系差.(3)同系物在烃分子中仅与一个碳相连的碳原子叫做伯碳原子(或一级碳原子,用1°表示)与两个碳相连的碳原子叫做仲碳原子(或二级碳原子,用2°表示)与三个碳相连的碳原子叫做叔碳原子(或三级碳原子,用3°表示)与四个碳相连的碳原子叫做季碳原子(或四级碳原子,用4°表示)(4)烷烃中碳原子的分类:与伯,仲,叔碳原子相连的H原子,分别称为伯,仲,叔H原子如:CH3CCH2CHCH3CH3CH31234CH31°°°°°有机化合物的命名的基本要求是必须能够反映出分子结构,使我们看到一个不很复杂的名称就能写出它的结构式,或是看到构造式就能叫出它的名称来。烷烃的命名法是有机化合物命名的基础,应很好的掌握它。2.2烷烃的命名常用的命名法习惯命名法系统命名法•(1)含有10个或10个以下碳原子的直链烷烃,用天干顺序“甲、乙、丙、丁、戊、已、庚、辛、壬、癸”10个字分别表示碳原子的数目,后面加烷字。•例如:CH3CH2CH2CH3命名为正丁烷。•(2)含有10个以上碳原子的直链烷烃,用小写中文数字表示碳原子的数目。•如CH3(CH2)10CH3命名为正十二烷。一.习惯命名法•(3)对于含有支链的烷烃,则必须在某烷前面加上一个汉字来区别。在链端第2位碳原子上连有1个甲基时,称为异某烷,在链端第二位碳原子上连有2个甲基时,称为新某烷。•CH3CH3•CH3CH2CH2CH2CH3CH3CHCH2CH3CH3-C-CH3•CH3•正戊烷异戊烷新戊烷•烷基:烷烃分子去掉一个氢原子后余下的部分。其通式为CnH2n+1-,常用R-表示。•常见的烷基有:•甲基CH3—•乙基CH3CH2—•正丙基CH3CH2CH2—•异丙基(CH3)2CH—•正丁基CH3CH2CH2CH2—•异丁基(CH3)2CHCH2—•仲丁基••叔丁基(CH3)3C—CH3CH2CHCH3三.系统命名法(IUPAC)•(1)直链烷烃按碳原子数命名•10以内:依次用天干:甲乙丙丁戊己庚辛壬癸.•10以上:用中文数字:十一....烷.(1)选择分子中最长的碳链作为主链,按这个链所含的碳原子数称为某烷,并以此作为母体。•选择主链(2)带有支链的烷烃CH3-CH2CHCHCH2-CH3CH2CH3CHCH3CH3Ñ¡Ôñ´íÎóÑ¡ÔñÕýÈ·CH3-CH2-CHCHCHCH-CH3CH3CH2CH2CH3CH3CH3Ñ¡ÔñÕýÈ·Ñ¡Ôñ´íÎó(2)分子中有两条以上等长碳链时,则选择支链多的一条为主链。(1)从最接近取代基的一端开始,将主链碳原子用1、2、3……编号CCCCCCCC2346781CCC876543215CCCCCCCC234615162±àºÅÕýÈ·±àºÅ´íÎó±àºÅÕýÈ·±àºÅ´íÎó碳原子的编号(2)若第一个支链的位置相同,则依次比较第二、第三个支链的位置,以取代基的系列编号最小(最低系列原则)为原则。A将支链(取代基)写在主链名称的前面B取代基按“次序规则”小的基团优先列出烷基的大小次序:甲基<乙基<丙基<丁基<戊基<己基<异戊基<异丁基<异丙基。C相同基团合并写出,位置用2,3……标出,取代基数目用二,三……标出。D表示位置的数字间要用逗号隔开,位次和取代基名称之间要用“半字线”隔开。E如果支链上还有取代基时,则必须从与主链相连接的碳原子开始,给支链上的碳原子编号。然后补充支链上烷基的位次、名称及数目。烷烃名称的写出CH3CHCHCHCH2CH3CH3CH2CH3CH3Ö÷Á´2£¬4-=¼×»ù-3-ÒÒ»ù¼ºÍé2.3烷烃的结构2.3.1甲烷的结构和sp3杂化轨道甲烷的球棒模型烷烃分子之中碳原子为正四面体构型。甲烷分子之中,碳原子位于正四面体构的中心,四个氢原子在四面体的四个顶点上,四个C-H键长都为0.109nm,所有键角∠H-C-H都是109.28´HHHHHCHHH109.5o0.109nm甲烷的正四面体构型sp3杂化轨道一个s轨道与三个p轨道形成四个sp3杂化轨道杂化就是由若干个不同类型的原子轨道混合起来,重新组合成数目相等的.能量相同的新轨道的过程。C的电子构型:1S22S22P2ÔÓ»¯¹â»ò2P2P2SSP32S»ù̬¼¤·¢Ì¬ÔÓ»¯Ì¬¼¤·¢sp3杂化轨道的特点:•(1)具有更强的方向性,能更有效地与别的原子轨道重叠形成稳定的化学键。每个sp3杂化轨道,各含1/4S成份3/4P成份。•(2)sp3杂化轨道的空间取向是指向正四面体的顶点。•(3)sp3杂化轨道夹角是109°28′,使四个键角之间尽可能的远离。4.在形成甲烷分子时,4个氢原子的S轨道分别沿着碳原子的SP3杂化轨道的对称轴靠近,当它们之间的吸引力与斥力达到平衡时,形成了4个等同的碳氢σ键。•σ键:沿键轴旋转,它的形状和位相符号不变。•σ键的特点:(1)重叠程度大,不容易断裂,性质不活泼。(2)能围绕其对称轴进行自由旋转。乙烷分子中C-C键(C-H键用直线表示)2.3.2其它烷烃的结构•乙烷的C-C键(Stuart)比例模型其他烷烃:据测定,除乙烷外,烷烃分子的碳链并不排布在一条直线上,而是曲折地排布在空间。这是烷烃碳原子的四面体结构所决定的。如丁烷的结构:烷烃分子中各原子之间都以σ键相连接的,所以两个碳原子可以相对旋转,形成了不同的空间排布。实际上,在室温下烷烃(液态)的各种不同排布方式经常不断地互相转变着。烷烃的构象•由于单键可以“自由”旋转。使分子中原子或基团在空间产生不同的排列,这种特定的排列形式称为构象。由单键旋转而产生的异构体,称为构象异构体或旋转异构体。几种构象的表示形式:伞形式锯架式纽曼投影式表示前碳表示后碳CCHHHHHHH2H2H2H2H2H2CHHHCHHH乙烷的构象HHHHHHHHHHHHHHHHHHHHHHHHHHHHHHHHHHHH(1)(2)(3)(4)(5)(6)由于碳碳键可以旋转,所以按照每旋转60°可得到的构象分别为:(1)球棒模型乙烷的重叠式构象重叠式、交叉式构象比较(3)纽曼投影式重叠式构象交叉式构象重叠式构象交叉式构象(2)透视式表示乙烷的构象乙烷分子各种构象的能量曲线12.6kJ/mol重叠式重叠式交叉式交叉式交叉式烷烃的物理性质:•1、状态:在常温常压下,1至4个碳原子的直链烷烃是气体,5至16(17)个碳原子的是液体,17个以上的是固体。•2、熔沸点:随分子量的增大而升高,原因:⑴分子量大,接触面积大,范德华力大•A烷烃的沸点随C数增加的变化:•1)直链烷烃的沸点随着分子量(碳数)的增加而有规律地升高,并且升高的趋势渐缓;•2)在含同数碳原子的烷烃异构体中,直链异构体的沸点最高,支链越多,沸点越低.B烷烃的熔点:1)直链烷烃的熔点随分子量(碳数)的增加而升高.2)支链烷烃的熔点比直链烷烃低.3.溶解度:烷烃是非极性分子,又不具备形成氢键的结构条件,所以不溶于水,而易溶于非极性的或弱极性的有机溶剂中。4.密度:烷烃是在所有有机化合物中密度最小的一类化合物。无论是液体还是固体,烷烃的密度均比水小。随着分子量的增大,烷烃的密度也逐渐增大。烷烃的化学性质稳定(特别是正烷烃)。在一般条件下(常温、常压),与大多数试剂如强酸、强碱、强氧化剂、强还原剂及金属钠等都不起反应,或反应速度极慢。原因:(1)其共价键都为σ键,键能大C-H390~435KJ/molC-C345.6KJ/mol(2)分子中的共价键不易极化(电负性差别小C2.5,H2.2)但稳定性是相对的、有条件的,在一定条件下(如高温、高压、光照、催化剂),烷烃也能起一些化学反应。2.6烷烃的化学性质2.6.4取代反应烷烃与某试剂可以发生反应,分子中原子或原子团可被其他原子或原子团取代,这种反应叫做取代反应。•烷烃卤代反应一般指氯代和溴代,而氟代剧烈(爆炸性反应),碘代很难直接发生•卤素反应的活性次序为:F2>Cl2>Br2>I2CH4+F2CH3F+HF=££´£²£·kJmol-1H=££±£°£µ£®£¸kJmol-1H=££³£±kJmol-1H=£«£µ£´kJmol-1HCH4+Cl2CH3Cl+HClCH4+Br2CH3Br+HBrCH4+I2CH3I+HIÇ¿ÁÒ·ÅÈÈ£¬ÒýÆð±¬Õ¨£®ÆäËûÍéÌþ·ú»¯Ê±£¬»¹·¢Éú£Ã££Ã¼ü¶ÏÁÑ·´Ó¦½øÐнϿ췴ӦÄÜ»ººÍ½øÐÐÔÚÊÒÎÂÏÂÎÞÃ÷ÏÔ·´Ó¦在紫外光漫射或高温下,甲烷易与氯、溴发生反应。CH4Cl2CH3HClClÂþÉä¹â甲烷的卤代反应较难停留在一元阶段,氯甲烷还会继续发生氯化反应,生成二氯甲烷、三氯甲烷和四氯化碳。若控制一定的反应条件和原料的用量比,可得其中一种氯代烷为主要的产物。比如甲烷:氯气=10:1(400~450℃时)CH3Cl占98%=1:4(400℃时)主要为CCl42.其他烷烃的氯代反应1)反应条件与甲烷的氯代相同(光照),但产物更为复杂,因氯可取代不同碳原子上的氢,得到各种一氯代或多氯代产物。例如:CH3CH2CH3Cl2£¬¹âCH3CH2CH2CH3CHCH3¶þÂÈ´úÎïÈýÂÈ´úÎïClClCH3CHCH2CH3CH2-CHCH2CH3CH3CH3-C-CH2CH3CH3ClCH3CHCHCH3CH3ClClCH3CHCH2CH2CH3Cl33.5%22%28%16.5%Cl2¹âCH32)伯、仲、叔氢的相对反应活性CH3-CH2-CH3Cl2CH3-CH2-CH2CH3-CH-CH3ClCl43%57%25¡æ¹â£¬分子中,有六个等价伯氢,两个等价仲氢,若氢的活性一样,则两种一氯代烃的产率,理论上为6:2=3:1但实际上为43:57=1:1.33这说明在室温氯代时,各类氢的反应活性是不一样的,氢的相对活性=产物的数量÷被取代的等价氢的个数。这样可知:²®ÇâµÄÏà¶Ô»îÐÔÖÙÇâµÄÏà¶Ô»îÐÔ=57/243/6¡Ö41即仲氢与伯氢的相对活性为4:1。异丁烷一氯代物CH3-CH-CH3CH3Cl2CH3CCH3CH3ClCH3CHCH3CH2Cl¹â¡æ25Ê嶡»ùÂÈÒ춡»ùÂÈ36%64%同理可求得叔氢的相对反应活性:ÊåÇâµÄÏà¶Ô»îÐÔ²®ÇâµÄÏà¶Ô»îÐÔ=36/164/9=5.11即叔氢的反应活性为伯氢的5倍。烷烃的卤代反应历程•反应历程•化学反应所经历的途径或过程,又称为反应机理。反应历程是根据大量的实验事实作出来的理论推导,实验事实越丰富,可靠的程度就越大。到目前为止,有些已被公认确定下来,有些尚欠成熟,有待于理论化学工作者的进一步努力。¦ÔhorCH4ClCH3HClCl2CH3-ClClCH3-ClClCH2-ClHClCH2-ClCl2CH2-Cl2Cl¡¤¡¤¡¤.............................................................................................................................................Á´Òý·¢Á´Ôö³¤½×¶ÎCl¡¤Cl¡¤Cl2ClCH3-ClCH3-CH3Á´ÖÕÖ¹½×¶Î¡¤¡¤¡¤¡¤¡¤¡¤¡¤¡¤¡¤CH3¡¤CH3¡¤¡¤CH3¡¤¡¤¡¤CH3ClCl2Cl2.7甲烷氯代反应历程从上可以看出,一旦有自由基生成,反应就能连续的进行下去,这样周而复始,反复不断的进行反应,故又称为链锁反应(freeradicalchainreaction)。凡是自由基反应,都是经过链的引发、链的传递、链的终止三个阶段来完成的。2.6.1氧化反应1、燃烧燃烧反应的机制非常复杂,但也是自由基反应。1、完全燃烧用途:·可用燃烧来测定它们的C、H含量。··很好的燃料。2、不完全燃烧烷烃的不完全燃烧会产生有毒的CO和黑烟C,是汽车尾气所造成的空气污染之一。用途:·炭黑是黑色的颜料。··可作为橡胶的填料,具有补强作用•3、部分氧化•在控制条件时,烷烃可以部分氧化,生成烃的含氧衍生物。例如石蜡(含20—40个碳原子的高级烷烃的混合物)在特定条件下氧化得到高级脂肪酸。•RCH2CH2R+O2RCOOH+RCOOHCH4+O2H2O+V2O5400~500¡æHCHOMnO2•有机氧化的概念:无机中的氧化的概念以电子的得失,氧化数的变化来判断是否是氧化还原反应。有机中的氧化的概念同无机中的氧化的概念有所不同,在有机中,加氧去氢为氧化,加氢去氧为还原。裂化:烷烃在隔绝空气的条件下加强热,分子中的碳碳键或碳氢键发生断裂,生成较小的分子,这种反应叫做热裂化。如:CH3CHCH2HHPyrolysisCH3+CHCH3..•产生的游离基:•1)可相互结合生产烷烃:•2)转移1个H给另1个游离基,产生1个烷烃和1个烯烃:•3)石油化工的催化重整CH3.CH3.+CH3CH3CH3+CH¡ª¡ªCH2..HCH4+CH2==CH2(1)石油(分馏产物);(2)天然气干天然气--甲烷86%~99%(体积)湿天然气--甲烷60%~70%,还含有一定的乙烷,丙烷,丁烷等气体.(3)油田气--低级烷烃,如甲烷,乙烷,丙烷,丁烷和戊烷等;(4)煤层气,沼气--甲烷等;(5)可燃冰甲烷冰.2.10烷烃的天然来源烷烃的制备1、甲烷的实验室制法:•2、偶联反应•(1).武慈合成法••特点:◆成倍增长碳链,只能制备对称烷烃。•◆可制备高级烷烃。CH4++CH3COONaNaOHNa2CO3CaO¡÷RXRXNa++R-RNaX+2•(2).柯尔贝电解法•特点:◆成倍增长碳链,只能制备对称烷烃。•◆可制备低级烷烃。RC+R-R+OONaH2OCO2+NaOHH2+Ñô¼«Òõ¼«•3、由不饱和烃加氢•4、卤烷还原+H2heatcatalystCHCH(1)CC+2H2heatcatalystCHCHHH(2)RX+H2Pd/BaCO3heatRH+HXRI+HIheatRH+I2•5、Grignard反应•6、由酮类还原RX+MgetherRMgXRMgX+H2O(HOR\')RH+MgXOH(OR\')RCOR\'H2N-NH2+KOH二缩乙二醇RCHR\'H(1)Wolff-Kishner(2)Clemmensen还原RCOR\'Zn(Hg),HClHeatRCHR\'H系统命名法系统命名法选含选含双键、叁键叁键的最长链为主链的最长链为主链((某烯某烯、、某炔某炔))使使双键、叁键叁键的编号最小的编号最小,,用数字表示位次用数字表示位次烯烃、炔烃、二烯烃““顺顺””、、““反反””命名法命名法顺顺2,2,52,2,5三甲基三甲基33己烯己烯(H3C)2HCHC(CH3)3H◆烯烃顺反异构的命名顺顺:两个双键碳上的相同:两个双键碳上的相同基团(或原子)在同一侧基团(或原子)在同一侧。。反反:两个双键碳上的:两个双键碳上的相同相同基团(或原子)基团(或原子)不在同一侧不在同一侧。。ZZ、、EE命名法命名法ZZ型:两个双键碳上的型:两个双键碳上的优先基团(或原子)在同一侧优先基团(或原子)在同一侧。。EE型:两个双键碳上的型:两个双键碳上的优先基团(或原子)不在同一侧优先基团(或原子)不在同一侧。。烯烃加成反应小结烯烃加成反应小结卤代卤代烷烷硫酸氢硫酸氢酯酯邻二卤代烷邻二卤代烷--卤代醇卤代醇醇醇醚醚酯酯取代环氧取代环氧乙烷乙烷CHCH2RHXHOSO3HHHHOR\'HR\'COOHCHCH3RXCHCH3ROSO3HCHCH3ROR\'CHCH3ROCOR\'CHCH3ROHH2OCHCH2RXXCHCH2ROHXH2OX2X2H2OCHCH2RO◇◇烯烃加成取向(反应的区位选择性)烯烃加成取向(反应的区位选择性)————MarkovnikovMarkovnikov规则(马氏规则)规则(马氏规则)MarkovnikovMarkovnikov规则:规则:氢原子氢原子总是加在总是加在含氢较多含氢较多的双键碳上的双键碳上CHCH2CH3CH2HBrCHCH2CH3CH2BrH+CHCH2CH3CH2HBr4:1CHCH2CH3H3PO4H2OCHCH2CH3OHCHCH2CH3OH主要产物+CCH2CH3CH3CCH2CH3CH3OCH3主要产物CH3OHHHH次要产物HBF4注:不对称炔烃加成取向也一样反马氏加成CH3CH2CH==CH2+HBrCH3CH2CH2CH2Br过氧化物过氧化物:H2O2,ROOR炔烃与卤化氢的加成与烯烃相似,遵守马氏定则,但反应速率稍慢.在过氧化物存在下,遵守反马氏定则.◇◇将将烯烃氧化成邻二醇烯烃氧化成邻二醇注:注:使使高锰酸钾溶液褪色高锰酸钾溶液褪色,,鉴别不饱和烃鉴别不饱和烃CCRR\'R\"HCCRR\'R\"HOHOHKMnO4(稀,冷),OH或(1)OsO4,(2)H2O①①高锰酸钾氧化高锰酸钾氧化◇◇将将烯烃氧化成酮或酸烯烃氧化成酮或酸CORR\'OCR\"OH+KMnO4(浓,热),HK2Cr2O7,H或CCRR\'R\"H((二二))氧化反应氧化反应((与氧化剂的种类与氧化剂的种类、条件等有、条件等有关关))顺式产物②②臭氧氧化臭氧氧化◇将◇将烯烃氧化成酮或醛烯烃氧化成酮或醛CCRR\'R\"HCORR\'OCR\"H+(1)O3(2)H2O,ZnCCH2RHCORHR(H)H(1)O3(2)H2O,Zn+OCH2(1)O3(2)H2O,ZnCOR(H)CHO◆◆炔烃的氧炔烃的氧化化羧酸羧酸羧酸羧酸羧酸羧酸甲酸甲酸CCRR\'KMnO4H+CR+O3H2OCCRHKMnO4H+O3H2O++OCO2OHCROOHCROOHCR\'OHOCHOHO+H2O(三)烯烃-H的卤代反应:碳碳双键是烯烃的官能团,与官能团直接相连的碳原子叫-C,连在-C上的H叫-H,-H受双键的影响,一定条件下被卤素取代.CH3CHCH2Cl2CH2CHCH2Cl高温注:这是自由基取代反应历程.CH3CHCH2NBSCH2CHCH2Br((四四))末端炔烃的特征反末端炔烃的特征反应应白色沉淀白色沉淀棕红色沉淀棕红色沉淀鉴定炔氢鉴定炔氢注:理解注:理解炔氢炔氢的酸性的酸性炔碳炔碳ss成分成分多,多,成键电子云成键电子云离核离核近近,电负性,电负性大大,,C-HC-H键的键的极性大极性大,键,键易易异裂出质子异裂出质子H,H,故酸性故酸性大大。。CCRHCCRAg(NH3)2+AgCCRCuCu(NH3)2+NaCCRNa+H2CCH二、共轭二烯烃的化学性质1.1,4-加成反应CHCHH2CCH2BrHCHCHH2CCH2HBrCHCHH2CCH2HBr(无过氧化物)+CHCHH2CCH2BrBrCHCHH2CCH2BrBrCHCHH2CCH2Br2+4040ooCC80%80%20%20%80%80%20%20%1,21,2-加成-加成1,41,4-加-加成成--8080ooCC注意:双键位置有变化其它名称其它名称二烯合二烯合成成[4+2][4+2]环加环加成成双烯体双烯体dienesdienes亲双烯体亲双烯体dienophildienophileses环己烯衍生环己烯衍生物物反应可逆反应可逆2.双烯合成(Diels-AlderDiels-Alder((狄尔斯-阿尔德反应))GW+GWGGorhv芳烃:即芳香烃,一般指含有苯环结构的烃类,具有芳香性.苯的结构•苯是芳香族化合物的母体,分子式为C6H6•无色液体,不溶于水,溶于烃类、醚类等有机溶剂.•芳香性:苯环容易发生取代反应,不易发生加成反应,对氧化剂稳定1.苯的Kekulé式1865年Kekulé(凯库勒)首先提出或2.苯的结构的近代观点(1)每个C都是sp2杂化,形成平面正六边形结构(碳碳键长都是0.139nm,C–C–C键角都是120°)(2)每个C上未参与杂化的p轨道垂直于苯环平面,彼此相互平行,从侧面互相重叠,形成一个包括6个电子离域的、封闭(即首尾相连)的共轭π键因此,用右边的式子表示苯的结构更为确切:为了讨论的方便,书中仍将沿用Kekulé式表示苯的结构,但是应当记住,苯分子中并不存在这样排布的单键和双键.芳烃的命名1.芳烃的命名(1)苯的一元取代物(没有异构体)–CH(CH3)2–CH=CH2异丙(基)苯苯(基)乙烯(2)苯的二元取代物(有三种异构体)–CH3–CH3–CH3–CH3–CH3H3C–邻二甲苯间二甲苯对二甲苯1,2–二甲苯1,3–二甲苯1,4–二甲苯(3)苯的三元取代物(三个取代基相同时,有三种异构体)连三甲苯偏三甲苯均三甲苯1,2,3–三甲苯1,2,4–三甲苯1,3,5–三甲苯(4)在较复杂的化合物中,命名时可以把侧链作为母体,而把苯环作为取代基.CH3CH2CHCHCH3CH32–甲基–3–苯基戊烷苯基:–、C6H5–苯甲基或苄基:–CH2–、PhCH2–、C6H5CH2–2.芳烃衍生物的命名(1)当取代基为–X、–NO2时,仍以苯为母体命名.–Cl–NO2–OCH3–OCH3–NO2–OH氯苯邻二硝基苯苯甲醚邻甲氧基苯酚1,2–二硝基苯2–甲氧基苯酚芳烃的取代1.取代反应(1)卤化+Cl2–Cl+HCl+Br2–Br+HBrFeCl3,△FeBr3,△(2)硝化–NO2+HNO3+H2O(HO–NO2)++亲电试剂:NO2HO–NO2+H2SO4NO2+H2O+HSO4–(3)磺化–SO3H+H2SO4(发烟或浓)+H2O(HO–SO3H)(苯磺酸)H2SO4△定位规律的应用1.比较取代反应的活性顺序CH3OHClCOOHNO2£¾£¾£¾£¾£¾第六章卤代烃RCCHHX¦Ä--¦Ä++¦Â¦Á¼î½ø¹¥£¬ÒýÆðÏû³ý·´Ó¦Ç׺ËÊÔ¼Á½ø¹¥£¬ÒýÆðÇ׺ËÈ¡´ú·´Ó¦1.取代反应RXNaOHH2OROHROR\'NaCNRCNRCOOHRCH2NH2NH3RNH2AgONO2RONO2AgXH2,Ni´Ë·´Ó¦¿ÉÓÃÓÚÖƱ¸¶àÒ»¸ö̼Ô×ÓµÄôÈËá¼°°·¡£´Ë·´Ó¦¿ÉÓÃÓÚ¼ø±ð±´úÌþ´Ë·´Ó¦¿ÉÓÃÓÚÖƱ¸´¼¡£+NaOR\'´¼´¼H2O,H+´¼´¼+ÏõËáõ¥制混醚CCXHCC+HXKOH,ÒÒ´¼2RX+2NaRR+2NaXXR+MgRMgX2.消去反应3.与金属的反应(1)与金属钠的反应(2)与金属镁的反应醇、酚、醚醇醇的结构、分类和命名法1.醇的结构醇(alcohol)的官能团是直接与饱和碳原子相连的羟基(–OH),醇羟基中O为sp3杂化,两个sp3杂化轨道分别与C和H形成σ键,其余两个sp3杂化轨道各有一对未共用电子,H–O–C的键角接近109.28`.2.醇的分类•根据羟基所连接的饱和碳原子的类型,可分为伯醇(1°)、仲醇(2°)和叔醇(3°).•根据所含羟基的数目,可分为一元醇和多元醇.•根据羟基所连的烃基结构,可分为饱和醇、不饱和醇和芳香醇.3.醇的命名法①普通命名法:根据羟基所连的烃基命名为某(基)醇.只适用于碳数不多、结构简单的醇.(例子见书)②系统命名法:命名原则:选主链、主链的编号例:CH3CHCH2CHCH3CH3OH4–甲基–2–戊醇•不饱和醇的命名:根据其不饱和键称为某烯醇或某炔醇.例:CH3CH=CHCH2OH2–丁烯醇(羟基位置为1时可省略)•多元醇的命名:CH3CHCH2CHCH3OHOH2,4–戊二醇•脂环醇的命名:根据脂环烃基命名为环某醇.如环己醇•芳香醇的命名:把苯环看作取代基.如2–苯基乙醇•常见俗名:酒精(乙醇)、甘油(丙三醇)、肌醇(环己六醇)醇的物理性质[补充]什么叫氢键?形成氢键的条件?XHY(静电作用)(分子间和分子内均可形成)X、Y:通常是F、O、N,电负性很大、体积较小、而且具有未共用电子对的原子.•氢键不属于化学键,但它有方向性和饱和性.•氢键比化学键弱,比范德华力强.•氢键对分子的物理和化学性质有明显的影响.为什么碱基配对原则是:A-T,G-C?∵相互间能够形成较稳定的氢键.(见P17习题8)1.状态低级一元醇为无色液体,具有特殊的气味(香味)和辛辣的味道.高级醇为无臭、无味的蜡状固体.δ+δ–2.水溶性主要与下列因素有关:①分子是否与水形成氢键.②分子的极性是否与水相近.•醇(ROH)在水中溶解度的大小取决于亲水性羟基和疏水性烃基所占的比例大小.3.沸点主要与下列因素有关:①分子间是否形成氢键.(影响明显)②分子间的范德华力大小.(与分子量和分子极性有关)•醇的沸点随碳数(或分子量)的增加而升高,随羟基数目的增加而显著升高.醇的化学性质醇的化学性质主要由羟基决定:R–CH2–O–H1.与活泼金属反应2HO–H+2Na2NaOH+H2↑(更快更剧烈)2RO–H+2Na2C2H5ONa+H2↑:2.酯化反应(属于亲核取代反应)醇与酸(无机酸和有机酸)之间脱水生成的产物称为酯.无机酸酯:ROH+HO–NO2RO–NO2+H2OCH2OHCH2ONO2CHOH+3HONO2CHONO2+3H2OCH2OHCH2ONO2甘油三硝酸酯(硝酸甘油)OO3ROH+HO–P–OHRO–P–OR+3H2OOHOR(HO)3P=O(RO)3P=O有机酸酯:ROH+RCOOHRCOOR+H2O′′H2SO4:•双分子反应机理:RCOHOH2ORCOHOHROH/ROH/RCOHOHOHR/RCOHOHR/OH2H2ORCOHOR/HHRCOR/OHµÚÒ»²½£¨¿ì£©µÚ¶þ²½£¨×îÂý£©亲核进攻重排3.与氢卤酸的反应R–OH+H–XR–X+H2OH+(2)分子间脱水醚2C2H5OHC2H5OC2H5+H2O伯醇简单醚•上述方法只适合制备简单醚R–O–R,混合醚R–O–R的制备一般采用Williamson法(SN2反应):RONa+RXROR+NaX醇钠伯卤代烃混合醚浓H2SO4140℃′′′5.氧化和脱氢反应•常用的氧化试剂:KMnO4溶液或K2Cr2O7酸性溶液,一般将伯醇直接氧化为羧酸(很难停留在醛的阶段):HOORCH–OHRC–HRC–OH•仲醇可被上述氧化剂氧化为酮(酮不易继续被氧化):OHOR–CH–R′R–C–R′•叔醇一般不被上述氧化剂所氧化(∵无α–H).但如果用更强的氧化条件,如与酸性KMnO4溶液一起加热,可使叔醇氧化断链,生成小分子氧化产物.采用特殊氧化剂CrO3–吡啶的CH2Cl2溶液,可使伯醇的氧化停留在醛的阶段:CH2=CHCH2OHCH2=CHCHO[O][O]CrO3–吡啶CH2Cl2[O]脱氢氧化CH3CHO+H2CH3CHOHHCu250-300¡æ伯醇仲醇CH3COHCH3HCu500¡æCH3CCH3O+H2叔醇CH3COHCH3CH3Cu¸ßβ»·´Ó¦6.多元醇类和烯醇的特性多元醇具有一元醇的所有性质.•邻二醇还具有一元醇所没有的一些特殊性质:(1)与氢氧化铜的反应CH2OHCH2–OCHOH+Cu2+CH–OCH2OHCH2OH此反应可用于区别邻二醇类化合物.(2)与高碘酸(HIO4)的氧化裂解反应R–CH–CH–R′+HIO4R–C–H+H–C–R′+HIO3+H2OOHOHOOR′R–C—CH—CH2+2HIO4R–C–R′+H–C–OH+H–C–HOHOHOHOOO+2HIO3+2H2OCu(绛蓝色配合物)OH–一、酚的酸性OH+NaOHONa+H2OONa+CO2H2OOH+NaHCO3OHC2H5OH>>>>BrClSPF>>>>>ONCDH(2)多原子取代基:先比较第一个原子COHO



















